光谱学基础知识
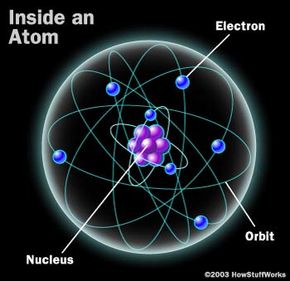
光谱学利用了所有原子和分子都能吸收和发射的事实光在特定的波长。要理解其中的原因,你必须了解原子是如何构成的。18新利最新登入你可以在18新利最新登入原子是如何工作的,但这里快速回顾一下会有帮助。1913年,一位名叫尼尔斯·玻尔的丹麦科学家采用了欧内斯特·卢瑟福的原子模型——一个密集的原子核被一个原子包围云并做了一些微小的改进,使之更符合实验数据。在玻尔的模型中,围绕原子核的电子存在于离散的轨道上,就像行星围绕太阳运行一样。事实上,我们对原子的经典视觉图像,比如右边的这个,就是模仿玻尔的概念。(此后,科学家们放弃了玻尔的一些结论,包括电子以固定路径围绕原子核运动的想法,而是设想电子聚集在原子核周围形成云团。)
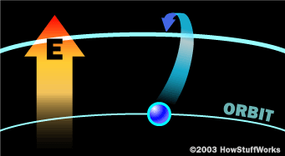
在波尔原子,在特定轨道上的电子与特定的能量有关。不像行星那样在轨道上保持固定,电子可以从一个轨道跳到另一个轨道。在默认轨道上的电子基态.为了从基态移动到远离原子核的轨道,电子必须吸收能量。当这种情况发生时,化学家说电子处于激发态.电子通常不能无限期地保持激发态。相反,它们会跳回到基态,这一动作需要释放出与它们最初被激发时相同的能量。能量以a的形式出现光子——最小的光粒子——在特定的波长,因为波长和颜色是相关的,在特定的颜色。
广告
周期表上的每个元素都有一组独特的玻尔轨道,其他元素都没有。换句话说,一种元素的电子存在于与另一种元素的电子略有不同的轨道上。由于元素的内部结构是独特的,当它们的电子被激发时,它们会发出不同波长的光。本质上,每个元素都有一个唯一的原子。指纹“它以一组波长的形式出现,或者是一个光谱.
威廉·沃拉斯顿和约瑟夫·冯·夫琅和费开发了第一种谱仪看元素的光谱指纹。光谱仪是一种既能散射光又能显示光以供研究的仪器。光进入一条窄缝,穿过透镜,透镜产生平行光束。这些光线穿过棱镜,棱镜使光线弯曲。每个波长的弯曲量略有不同,因此产生了一系列彩色波段。第二个透镜将光线聚焦在一个出口狭缝上,一次允许一种颜色的光通过。科学家们经常使用安装在转盘上的小型望远镜,以便更容易地观察穿过狭缝的颜色。然后,科学家旋转望远镜或棱镜,使另一种颜色进入视野。通过观察棱镜的角度望远镜,就可以确定射出光的波长。使用分光镜分析样品可能需要几分钟,但它可以揭示很多关于光源的信息。一些光谱仪,被称为的光谱仪,用来拍摄光谱。
如你所料,光谱仪是化学家进行激光光谱学的必备工具。接下来,我们将简要介绍一些最重要的激光光谱学类型。