原子拔河
“电负性是原子对电子亲和力的衡量,它是每个原子的内在特征,”麻省理工学院副教授埃里克·费雷拉(Eric Ferreira)说化学系在佐治亚大学。“这是基于原子特有的许多因素,包括原子核中的大小和质子数。”
一个原子的电负性本质上是测量共享电子比另一个原子更靠近该原子的相对可能性。
广告
“这有点像两个人用一根绳子玩拔河,”费雷拉说。“个体就是原子核,绳子就是电子。如果每个人都用同样的力量拉,那么绳子就会被平分。但如果一个人比另一个人用力拉,那么更多的绳子就会开始聚集在用力拉的人身上。从本质上讲,用力拉的人电负性更强,将绳子(或电子)密度拉向它。”
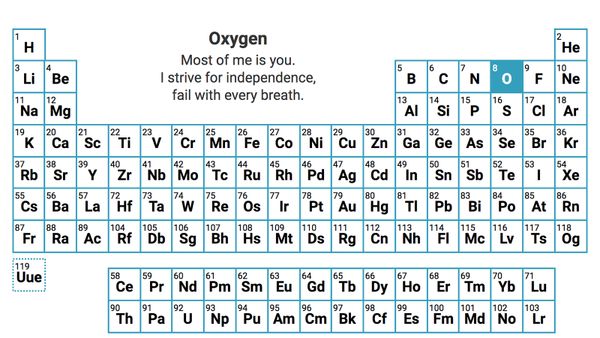
你应该记得高中化学课上讲过,原子核中的质子带正电,因此吸引带负电的电子围绕它们运行。当两个原子结合在一起时,它们结合在一起的一种方式是共用一对电子,这被称为共价键。但是共价键中的原子可能不会平等地共享电子的监护权——如果两个不同元素的原子在共价键中共享电子,电子可能会比另一个原子更接近一个原子核。一个很好的例子是水分子中一个氧原子和两个氢原子之间形成的键:氧原子的原子核比氢原子的原子核更能吸引共享的电子。因此,氧原子比氢原子的电负性更强氧原子比氢原子更容易把电子吸引到原子核。
广告
每天的电负性
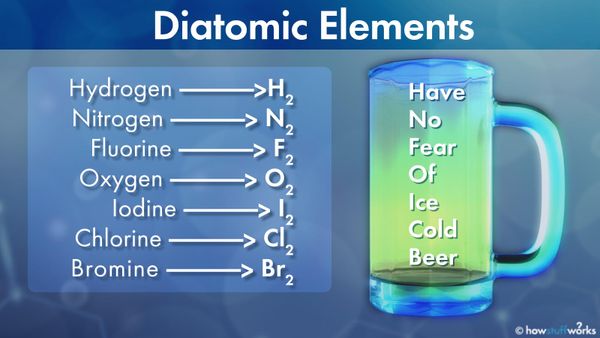
人们每天利用电负性的一个很好的例子是聚四氟乙烯(PTFE),它可以涂在平底锅上,防止你的炒鸡蛋粘在上面。这种聚合物是碳对碳键的长链,其中每个内部碳原子也有两个氟原子与之相连。在所有元素中,氟的电负性最强,所以成键的电子被紧紧地束缚在氟原子上。
分子可以通过特殊的相互作用相互吸引,比如伦敦色散力.当分子中不断移动的电子被拉到分子的一个区域时,这些力就产生了,在分子中产生了带更多负电荷的点和带更多正电荷的点。
广告
在特氟龙的特殊情况下,由于氟的电负性很强,它的原子核使电子移动的数量最小化——氟原子对电子的吸引力太大了,以至于它们根本不想在碳原子核周围闲逛。这意味着电子运动将产生吸引的伦敦色散力被抵消,这导致了特氟龙的“不粘”特性。
电负性也在药物的创造中发挥作用:
费雷拉说:“许多药物都是小分子的,它们被设计成与体内具有特定功能的某些蛋白质相互作用。”“这些相互作用是基于分子的物理形状来精确地适应蛋白质受体的形状——就像一把钥匙适合一把锁。这些分子间的相互作用可以基于静电力,因此人们可以根据特定原子的电负性来设计电子性质被“调谐”的药物,以最大限度地发挥相互作用的功效。”
所以,下次你喝水或做烤奶酪三明治或吃药的时候,感谢化学让每一种元素都有所不同——而且有些元素比其他元素更有吸引力。
广告